Kanser enerji metabolizmasının en temel yapılarından biri olan Warburg etkisi, bir kanser hücresinin can damarlarından biri. Peki bunu nasıl yapıyorlar? Biz biliyoruz ki kanser hücresi, normal sağlıklı bir hücreye kadar 18 kat daha hızlı enerji üretir. Bu enerjiyi ise aslında normal gibi gözüken ama belirli anomalilerin olduğu bir yolu tercih ederek yapar. İnsanlar ve bir çok canlı (mitokondri ihtiva edenler) glikoliz ve kreps gibi devamlı bir döngü ile genel enerji gereksinimlerini karşılarlar peki, kanser hücresi ne yapar ? kanser hücresinin mantığında hızlı üremek, hızlı enerji üretmek, bunu depolamadan bir o kadar hızlı harcamak ve nihai olarak metaztaz (yayılmak) ile bulunduğu organizmayı ele geçirmek vardır. Detaylar yazı içeriğinde…
NOT: Yazıyı okumadan önce glikoliz ve kreps konularına göz atmakta fayda var.
MİTOKONDRİ METABOLİZMASI VE WARBURG ETKİSİ
Tümör hücreleri incelendiğinde yoğun bir enerji üretiminin söz konusu olduğu anlaşılmıştır. Tümör hücrelerinde; tümör süpressörlerinin kaybı veya mutasyonu söz konusudur. ‘’Fosfoinositid-3-kinaz’’ (P13K) ‘ nın aktivasyonu tümör hücrelerinde gözlenen yüksek seviyedeki aerobik glikolizin ana regülatörüdür. P13K bir tür büyüme faktörü olup hücrede PTEN (negatif regülatör) kaybedilmesi tümör hücrelerinde sıklıkla P13K yolunu aktive eder.
Tümör hücreleri normal sağlıklı hücrelerle karşılaştırıldığında çok daha fazla glikoz kullandıkları açığa çıkıyor. En basit şekli ile tümör hücrelerindeki bu yüksek orandaki aerobik glikoliz warburg etkisi olarak açıklanmaktadır.
Glikolizin normal hücrelerde 2 ATP kazancı sağladığını bilmekteyiz. Peki kanser hücresi bu bol enerjisini nasıl sağlamaktadır?
Cevap: Kanser hücreleri normal hücrelere göre 18 kat daha hızlı bir şekilde glikoliz’i gerçekleştirmektedir.
Kanser hücrelerinin bu özellikleri, normal hücrenin Glikoliz+TCA siklusundan elde ettiği toplam enerjinin (Net: 36 ATP), kanser hücresinde sadece glikoliz aşamasından elde edildiğine bir kanıt niteliğinde olup, Warburg etkisi olarak tanımlanmıştır.
[Ayrıca Ras ve Myc gibi onkogenler aracılığıyla glikolitik enzimler ve glikoz taşınımı artar…]
LDH-A (Laktat dehidrojenaz-A) enzimi
Kanser hücrelerinde en önemli glikolitik enzim LDH-A (Laktat dehidrojenaz-A)’dır. Nihai görevi onkogenlerde glikolizi arttırmaktır. Ayrıca NAD+ glikolizin devamlılığı için gereklidir (elektron transport). LDH-A’nın tümör hücrelerinde aşırı ekspresyonu, NADH’ın hızla NAD+ ‘e yükseltgenmesine, dolayısıyla aerobik koşullarda glikolitik akışı arttırmasına izin verir.
[Normal hücrelerde LDH expresyonu azdır (Aerobik koşullar altında)…]
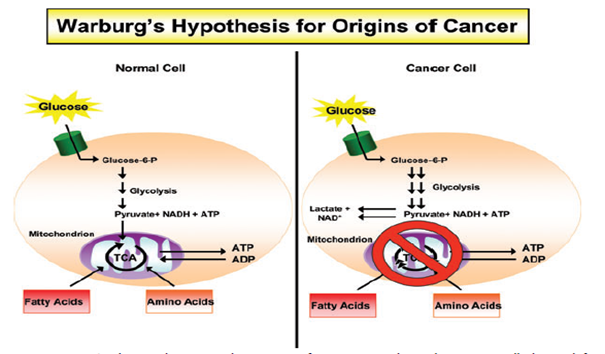
Görsel 1: Kanserli ve Normal Hücre Enerji Metabolizmaları ( Mitochondrial Metabolism and Cancer )
Yukarıdaki şemada’da gösterildiği gibi enerji metabolizması yönünden normal ve kanserli hücre arasındaki en önemli fark ; kanserli hücrelerde TCA siklusunun HIF ve PDK ile down regüle edimesidir.
p53 geni
p53 geni glikoliz için downregülatör bir gendir.Ayrıca P53 aktivasyonu SCO2* (sitokrom oksidaz 2 sentetaz) ekspresyonunuda uyarır.Dolayısıyla p53 ekspresyonu azaltılır, AKT ( büyüme faktörü) ekspresyonu artar. Dolayısıyla glikoliz ve hücre proliferasyonu artar.
[*SCO2: Sitokrom c ‘den moleküler oksijene indirgenen eşdeğerliklerin transferini katalize eder ve iç mitokondri membranı boyunca protonları pompalar.]
HIF-1 ve Warburg Etkisi
HIF-1 bir transkripsiyon faktörüdür.HIF-1’in temel görevi glikoliz için glikolitik enzim ve glikoz transportla ilgili genlerin ekspresyonunu arttırmaktadır.HIF-1’in temel görevi glikoliz için glikolitik enzim ve glikoz transportla ilgili genlerin ekspresyonunu arttırmaktadır.
PDK1, pirüvatın asetil-CoA’ya dönüştürülmesinden sorumlu olan enzim olan PDH’ı ( pirüvat dehidrojenaz) inaktive eder. Böylece asetil- CoA’nın TCA döngüsüne ve ETS’ye verilen NADH ve FADH2’lere indirgenmesini azaltır. Dolayısıyla ‘’KANSER HÜCRESİNDE TCA SİKLUSU İNDİRGENMİŞ OLUR’’.
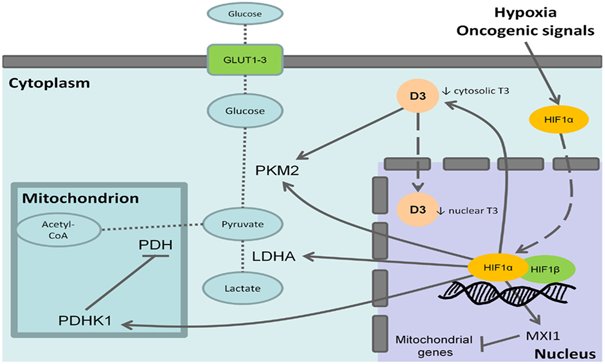
HIF-1’in en önemli özelliklerinden biride hipoksi ile indükleniyor olmasıdır. Ayrıca HIF-1’in iki alt ünitesi mevcuttur ; HIF-1α ve HIF-1β dır.
Tümör hücresinin proliferasyonunda glikolizin rolü
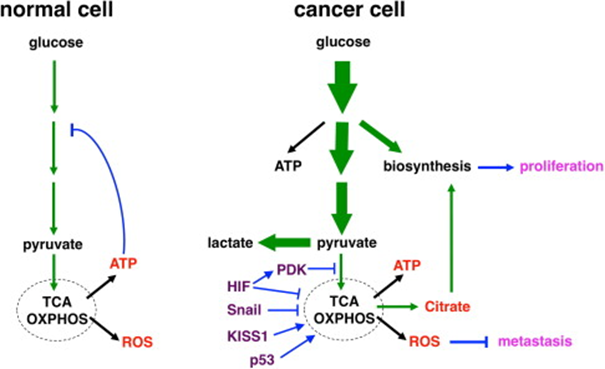
Görsel 3. Normal ve Kanserli Hücre Enerji Yolakları ( Mitochondrial Metabolism and Cancer)
- LDH-A nın pirüvatı laktata dönüştürdüğü biliniyor ve burada hedef gen c-myc’dir.
- Çalışmalarda PDK baskılanmış ve tömür büymesinin yavaşladığı gözlenmiştir.
- İlk bakışta bu sonuçlar tümör proliferasyonun glikoliz bağlı olduğunu göstermekte.
- Bazı tümör hücrelerinin pentoz-fosfat yolunu beslemek için yeterli substuratlar bulduğu sürece glikozun yokluğunda’da kültürde büyüyebildikleri gözlenmiştir.
- Pentoz-Fosfat yolunu desteklemek için yüksek seviyelerde aerobik glikoliz gerekli olabileceğini düşünülmüş.
- Bu hipotezi destekleyen dönüştürülmüş insan mezenkimal kök hücreler, riboz-5-fosfat üreten ve DNA sentezinde rol oynayan enzimlerde artışa neden olan pentoz fosfat yolunun RPIA (riboz-5-fosfat izomeraz A) tarafından upregülasyonu sergilenmektedir.
- PKM2 (Pirüvat kinaz M2) keşfedilmiş, bu PKM2 pürivat kinazın bir izoformu olup, glikolizin son adımının düzenlenmesinde görev almaktadır.
- Overekspre edilen tümörlerde ve PKM2 ‘nin inaktivasyonu insan akciğer kanseri hücrelerinde xenograf tümör büyümesini azalttığı gözlenmiş.
[Bu çalışmalar ışığında Warburg etkisine alternatif bir açıklama getirilmiş; ‘’Yüksek hızla çoğalan tümör hücreleri, nükleotid üretmek ve pentoz-fosfat yolu için glikolitik ara ürünler sağlamak amacıyla yüksek glikolitik akış gerektirmektedir.’’]
Mitokondrial Metabolizmanın Tümör Proliferasyonundaki Etkisi
Warburg’un ilk hipotezi, kanserin solunumda meydana gelen hasar sonucu kaynaklandığı ve hücrenin oksidatif fosforilasyondan kaybettiği ATP’yi glikolizdeki artışla dengelemeye çalışması şeklindedir. Tümör hücrelerinde yüksek seviyede aerobik glikoliz gözlendiği doğrulanmış, mitokondrinin tümör hücrelerindeki rolü ise tartışmalı şekilde kalmıştır. Ancak artan glikoliz tek başına solunum bozukluğu ile açıklanamayacığı öngörülmüş.
Bir çok araştırmacı mitokondrial metabolizma ve solunum hızında bir düşüşün tümör hücresi proliferasyonunda gerekli olduğunu savunmuş olsalar da, çok sayıda çalışma mitokondrinin çoğu tümör hücresinde gerçekten işlevsel olduğunu göstermiştir.
[Mitokondrial biyogenezde Myc onkogeni, mtDNA transkripsiyonu ve OXPHOS fonksiyonu önemli bir yere sahiptir.]
Yapılan çalışmalarda; yüksek mitokondrial zar potansiyeline sahip fare embriyonik kök hücreleri teratom oluşturabilirken, düşük membran potansiyeline sahip fare hücrelerinin farklılaşır.
İlginç bir şekilde, hipoksik hücreler tarafından üretilen aşırı laktat, komşu normoksik hücrelere taşınabilir. Monokarboksilat taşıyıcı 1 (MCT1) ve mitokondrial metabolizma sağlamak için pirüvata dönüştürülür. MCT1 inhibisyonu normoksik tümör hücrelerinde laktattan ziyade büyük miktarlarda glikoz tüketimi ile sonuçlanır ve hipoksik tümör hücrelerine sınırlı glikoz temin edilebilir. Bu durum hipoksik tümör hücrelerinin kombine bir glikoz ve oksijen yokluğuna bağlı hücre ölümüne yol açar.
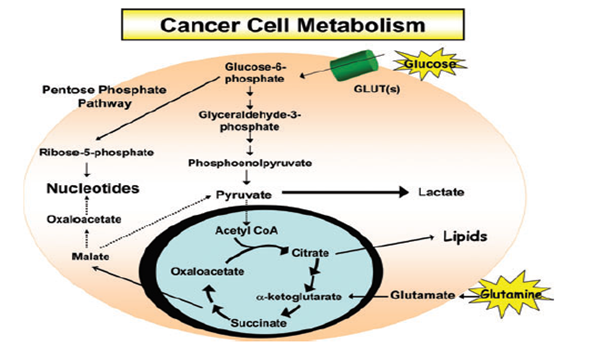
Görsel 4.Kanser Metabolizmasında Glukoz ve Glutamin ( Mitochondrial Metabolism and Cancer )
25 yıl kadar önceki çalışmalar Hela (Ovaryum Kanseri) hücre kültürlerinin glukoz yerine substurat olarak ‘’glutamin’’ i metabolize edip prolifere olduklarını göstermiştir.
GLUTAMİN & Myc
- Myc onkogenin hücrelere glutamin kullanmaları için bir tür teşvik sinyali verdiği gözlenmiştir.
- İlk çalışmada Myc dönüştürülmüş hücreler α-Ketoglutarat üretilmesi ile TCA ara maddelerine gerekli olan glutaminin tüketimi gözlenmiştir.
- Myc dönüştürülmüş hücreler glutamin yokluğunda hücre ölümüne gitmişlerdir.
- Myc ifade eden hücrelerde glutaminazı susturmak hücre proliferasyonunu azaltır; bu kusur kısmen oksoloasetat ile onarılabilir, okasoloasetat bir TCA ara maddesidir. Son olarak Mitokondri metabolizması ve hücre büyümesi için glutamin önerilmiştir.
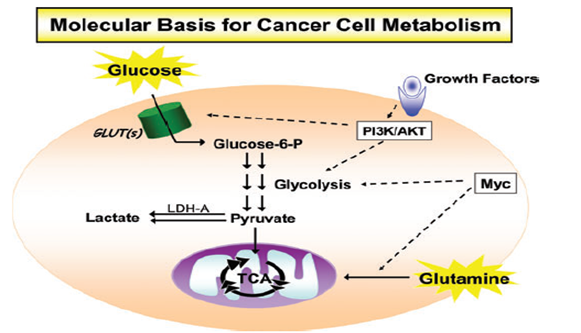
Görsel 5.Kanser Metabolizmasının Genel Girdi ve Çıktıları (Mitochondrial Metabolism and Cancer)
-Science is Everything-
İlginizi Çekebilir :
Kanserin Çözümü ”Kanser Kök Hücresi” Olabilir mi?
Yapay Zeka Meme Kanserini Teşhis Edebiliyor!
Samsung Kanserli Çalışanlar İçin fon kuruyor !
Kaynak ve İleri Okumalar :