Geçtiğimiz günlerde Birleşik Krallık, Dünya’da ilk kez bir CRISPR/Cas9 gen düzenleme terapisini onayladı. Onaylanan terapi, orak hücreli anemi ve transfüzyona bağımlı β-talasemi hastalıklarını tedavi etmeyi amaçlıyor. İsviçre’nin Zug şehrindeki Vertex Pharmaceuticals ve CRISPR Therapeutics tarafından geliştirilen terapi, Casgevy ismiyle anılıyor ve bu alanda Jennifer Doudna ve Emmanuelle Charpentier’in CRISPR/Cas9 gen düzenleme teknolojisini geliştirmesinin üzerinden tam 11 yıl sonra onaylanan ilk terapi olma unvanını elinde taşıyor.
İlaç ve Sağlık Ürünleri Düzenleme Ajansı’ndan (Medicines and Healthcare Products Agency) alınan onay, Vertex için büyük bir önem taşırken CRISPR camiası ve biyoteknoloji boyutunda büyük bir bilimsel başarı olmakla birlikte önemli bir dönemeç oluyor.
Bu onay aynı zamanda, Amerika Birleşik Devletleri Gıda ve İlaç İdaresi’nin (FDA) orak hücre hastalığı için 8 Aralık’ta ve β-talasemi için 30 Mart 2024’te beklenen onayları için zemin hazırlıyor. Ancak, başlangıçta bu pahalı ve kompleks tedaviden oldukça az sayıda hastanın faydanalanabileceği belirtiliyor. Bunun yanında bu tedaviye erişimi olabilecek hastaların da hem sağlık altyapılarının bu teknolojide hala sınırlı olması hem de bugüne kadar bu tarz bir tedavinin tecrübe edilmemiş olmasından dolayı terapiyi bekletmeyi tercih edebilecekleri belirtiliyor. Birleşik Krallık’ın bu kararı almasındaki en önemli etken, değerlendirmeye alınan 29 hastanın 28’inde, genelde hastaneye yatırılmayı gerektirecek boyutta ağrılara sebep olan iltihaba bağlı atakları engellediği yani yaklaşık %97’lik bir başarı oranı yakalamasından kaynaklanıyor. Tedavinin uzun vadede inme ve organ hasarını da azaltıp azaltmayacağı ve en önemlisi yaşam beklentisini uzatıp uzatmayacağı ise henüz belli değil. Uzun dönem güvenlik profili ve risklerinin de henüz kesin olarak bilinmiyor olmasına rağmen şu ana kadar yapılan testlerde yapılan DNA’daki çift sarmal kırıkları henüz bir genetik toksisiteye yani DNA hasarlarına yol açmıyor. Yine de bu risklerin göz ardı edilemeyeceği ve uzun vadeli etkilerinin kesin olarak bilinmediği belirtiliyor. Vertex, orak hücre hastalığı ve β-talasemi denemelerindeki hastaları, maligniteleri, mortaliteyi (ölüm yüzdesi) ve diğer hastalık ve tedavileri ile ilgili parametreleri izlemek amacıyla 15 yıl sürecek bir güvenlik çalışmasına dahil etmeyi planlıyor[1]. Peki orak hücreli anemi hastalığı nedir ve bu gen düzenleme terapisi bu hastalığı nasıl çözüyor daha yakından inceleyelim:
Orak Hücreli Anemi Hastalığı Nedir?
Orak hücreli anemi hastalığı, kırmızı kan hücrelerinde yani alyuvarlarda görülen bir hastalıktır. Normal alyuvarlar, hemoglobin ismi verilen bir protein aracılıyla damarlarda oksijen taşırlar ve yuvarlak bir şekle sahiptir. Ancak, orak hücreli anemi hastalığı görülen kişilerde “C” ya da “Orak” şekline bürünen alyuvarlar normal alyuvarlara göre daha kısa sürede ölür ve hastada alyuvar eksikliğine yol açar. Ayrıca, şekillerinden dolayı orak şekilli alyuvarlar damarlarda sıkışmalara sebep olabilir, kan akışını olumsuz etkileyebilir ve kişide ağrılara, enfeksiyonlara ya da felç gibi ciddi komplikasyonlara sebep olabilir. Orak hücreli anemi hastalığı kalıtsaldır ve HbSS, HbSC, HbS ve birkaç farklı türü daha bulunabilir. Hastalığa sebep olan temel şey, hastaların miras aldığı genlerin anormal hemoglobin proteini kodlamasından kaynaklanır. Örneğin, HbSS orak hücreli anemi hastaları anne ve babasından Hemoglobin S kodlayan birer gen miras alır ve Hemoglobin S normal hemoglobinden farklı olarak alyuvarların orak şeklini almasına yol açar. HbSC türünü taşıyanlar ise ebeveynlerinin birinden Hemoglobin S kodlayan geni miras alırken diğerinden Hemoglobin C kodlayan bir gen miras alır. Hemoglobin C benzer şekilde anormal bir hemoglobin kodlar ancak bu tür taşıyıcılarda hastalık daha hafif seyreder[2].
CRISPR İle “Gen Düzenleme” Mantığı Nedir?
“Clustered Regularly Interspaced Short Palindromic Repeats” yani Kümeleşmiş Düzenli Aralıklı Kısa Palindromik Tekrarlar” olarak bilinen CRISPR, ilk olarak bakterilerin kendi genomlarını işgal eden virüslere karşı geliştirdiği bir bağışıklık sistemi olarak keşfedildi. Ancak, keşfinden kısa bir süre sonra, Cas9 enziminin programlanabilir ve düzenlenebilir olması, tıp ve biyoloji alanlarında devrim niteliğinde bir buluşa yol açtı. Cas9 enziminin düzenlenebilir olması, CRISPR-Cas9’un gen düzenleme amaçları için kullanılabileceğini ortaya koydu ancak CRISPR-Cas9, gen düzenlemenin yanı sıra gen regülasyonları, epigenetik düzenlemeler, kromatin mühendisliği gibi birçok farklı alanda da kullanılmaya başlandı. CRISPR-Cas9’un çalışma prensibi, spesifik DNA bölgelerini tanıyıp bağlanan rehber RNA’ları (guide RNA ya da gRNA) kullanan Cas9 enziminin bu bağlanma sonucunda DNA’nın çift sarmal yapısında kesikler oluşturmasına ve bu kesik bölgelere istenen DNA zincirlerinin eklenmesine dayanıyor. Aşağıdaki görselde, CRISPR-Cas9 sisteminin genel çalışma prensibi basitleştirilmiş şekilde bulunuyor. Ancak, yukarıda da belirtildiği gibi CRISPR gen düzenlemenin yanı sıra birçok farklı amaçla kullanılabiliyor ve bunlar Cas9 enziminin, gRNA’nın farklı şekillerde programlanmasına ya da Cas9 enzimi yerine Cas12 gibi farklı enzimlerin kullanılmasına dayanıyor[3].
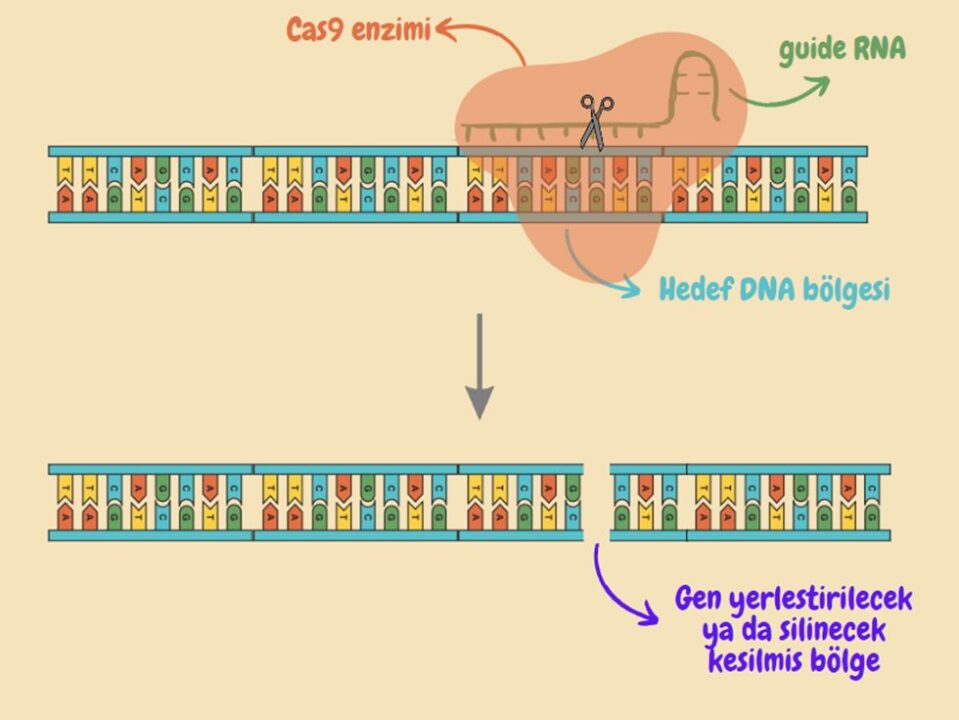
CRISPR Terapisi Hastaları Nasıl Tedavi Edecek?
Casgevy, orak hücreli anemi hastalığına sebep olan mutasyonu düzeltmek yerine normalde doğumdan kısa bir süre sonra inaktive olan ve fetüsteki ana oksijen taşıyıcı olan fetal hemoglobin üretimini indükleyerek yetişkin taşıyıcıdaki hemoglobin eksikliğinin önüne geçmeyi hedefliyor. γ-globin, α-globin ile birleşerek tetramerik yapıdaki hemoglobin proteinini oluşturur ve BCL11A geninin transkripsiyonu γ-globin üretiminden sorumlu genin transkripsiyonunu baskılar. Casgevy’nin çalışma mantığı, aynı zamanda eritrositlere (kırmızı kan hücreleri) özgü bir gen transkripsiyonu hızlandırıcı olan BCL11A geninden mRNA sentezlenmesinin engellenmesine dayanıyor. Ayrıca, Casgevy ile fetal hemaglobin ekspresyonu (ya da ifadesi) artar ancak kırmızı kan hücrelerindeki miktarı hala değişim gösteriyor. Bu konu hakkında Birmingham’daki Alabama Universitesi’nde bulunan Yetişkin Orak Hücreli Anemi Kliniği’nin direktörü Julie Kanter, “Bir şeyin sırf orada olması onun yeterli olduğu anlamına gelmez.” diyor. Kırmızı kan hücrelerinin oraklaşmasının zararlı etkileri, özellikle fetal hemoglobin seviyeleri, toplam hemoglobin yüzdesi olarak koruyucu eşik olarak kabul edilen %20’nin altına düşerse devam edebilir.
Daha detaylı anlatmak gerekirse Casgevy, hastaların kemik iliğinden izole edilen CD34+ hematopoietik kök hücrelerini hedef alıyor. Bu uygulama hastaların kemik iliğinden izole edilen CD34+ hematopoietik kök hücrelerine yöneliktir ve CRISPR düzenleme bileşenleri, bir sentetik rehber RNA ve Streptococcus pyogenes Cas9 endonükleazını içeren bir ribonükleoprotein kompleksi olarak laboratuvarda elektroporasyon ile uygulanır. Casgevy’nin uygulanması, hastalığın hematopoiezi üzerindeki etkisi nedeniyle karmaşıktır. Hastaların hücre mobilizasyonundan önce iki ay boyunca kan transfüzyonu ve ardından iki tur mobilizasyon ve aferez geçirmeleri gerekir (β-talasemide, aksine, tedavi öncesi transfüzyona gerek yoktur ve genellikle tek bir mobilizasyon ve tek seferlik aferez yeterlidir). Düzenlenen hücrelere yer açmak için, hastaların ayrıca oldukça toksik olan busulfan bazlı miyeloablatif ön koşullandırmaya tabi tutulmaları gerekir. Vertex, Amerika Birleşik Devletleri’nde tedavi için uygun gördüğü hastaları (12 yaş ve üstü, hastalığı ciddi bir boyutta olan ve sürekli tekrarlayan atakları olan kişiler) kapsayacak yaklaşık 50 tedavi merkezi oluşturmayı hedeflediğini belirtiyor. Tabii ki bunun personel yükü oldukça fazla olduğu ve mecvut tedavi merkezlerinin buna ayak uydurması ve vites yükseltmesi de zaman alacağı belirtiliyor. Ancak, Kanter, organizasyonunun zirve döneminde, eğer onaylanırsa, Casgevy veya Bluebird Bio’nun lentiviral gen terapisi Lovotibeglogene Autotemcel’i yılda yaklaşık 12 hastaya uygulayabileceğini söylüyor. Lakin, bunların da ekstra personel ihtiyacı doğuracağı ve zamana ihtiyaç duyulduğu belirtiliyor. Bunlar göz önüne alındığında mecvut tedavi seçeneklerinin de öne çıkabileceği belirtiliyor ki zaten orak hücre hastalığı içi hemaopoetik kök hücre nakli (HSCT) hala önemli bir tedavi seçeneği olarak görülüyor. Eşleşmiş kardeş donörlerden alınan allojenik HSCT, hastalar için iyileştirici olabilir, ancak oldukça az sayıda hastanın mükemmel eşleşmiş bir kardeşi bulunuyor. Donör ve alıcı lökosit antijen lokusları arasında sadece kısmi bir eşleşme gerektiren siklofosfamid tedavisini takiben haploözdeş HSCT, çok daha geniş bir popülasyona ulaşabilecek bir seçenek olarak karşımıza çıkıyor. Dahası, bu yaklaşım miyeloablatif tedavi gerektirmiyor ve yaklaşık 400.000 dolarlık bir maliyetle, genetik yaklaşımlardan önemli ölçüde daha ucuz olması dikkat çekiyor. Hasta başına maliyeti 2 milyon dolara kadar çıkan Casgevy ve diğer gen terapilerinin fiyatlandırmalarına bakıldığında maliyeti yaklaşık 400.000 dolar olan bu teknik görece daha ucuz kalıyor. Bu bağlamda, Vanderbilt Üniversitesi Tıp Merkezi’ndeki Vanderbilt-Meharry Orak Hücre Hastalığında Mükemmeliyet Merkezi’nin kurucusu ve direktörü Michael Rutledge DeBaun, hastalarla tedavi seçenekleri hakkında yapılan herhangi bir konuşmanın tamamen şeffaf olması gerektiğini söylüyor.
Bu konuşma fiyatların yanında, yüksek riskli bir tedaviyi şimdi mi yoksa daha iyi alternatiflerin beklenmesini mi tercih edeceklerine ilişkin avantaj ve dezavantajların tartılmasını da içeriyor. “Hastalarımıza ne sunduğumuz ve ne sunmadığımız konusunda net olalım,” diye ekliyor. Kısa dönem prognozu (hastalığın seyri hakkındaki öngörüleri) kötü olan çocuklar ve yetişkinler yeni tedaviler için en iyi adaylar olarak görülüyor ancak “Çocuklar için kötü bir sonuç almadan önce onları tedavi etmemiz gerektiği fikrini reddediyorum” diyor DeBaun. Ayrıca Casgevy’in onayının ötesinde başka seçenekler olacağını da düşünüyor DeBaun. “Belki bugün değil ancak gelecekte çok daha iyi sonuçlar verecek bir dizi tedavi seçeneğine sahip olacağımız konusunda ihtiyatlı bir şekilde iyimserim” diyor. Bununla birlikte, orak hücre hastalığı olan çoğu insanın böyle bir seçeneği şu an yok ve gelecekte de olmayabilir. Bu eksiklik en çok Sahra altı Afrika’da hissediliyor ve çoğu hasta düşük gelirli ülkede görülüyor. Nijerya’da ve Amerika Birleşik Devletleri’nde geniş deneyime sahip olan DeBaun, şu an en acil olan durumun tüm hastaların fetal hemoglobin üretimini artıran ve kriz sıklığını azaltan ucuz bir ilaç olan hidroksiüreye erişiminin tedarik edilmesi olduğunu belirtiyor. Bu ilaç görece daha zengin ülkelerde son on ya da 20 yıllık zaman zarfında tedavilerin temelini oluşturuyor ancak hala Nijerya veya diğer Afrika ülkelerinde geniş çapta bulunmasında zorluklar yaşanıyor. Durum böyleyken ne yazık ki, çoğu hastanın hastalığının seyrini azaltma konusunda devrim niteliğindeki yeni gen düzenleme tedavilerinin gelmesi bu tarz ülkelerde gerçekten herhangi bir fark yaratmayacak gibi duruyor[2].
REFERANSLAR
[1] Sheridan, C. (2023) ‘The world’s first CRISPR therapy is approved: Who will receive it?’, Nature Biotechnology, 42(1), pp. 3–4. doi:10.1038/d41587-023-00016-6.
[2] What is sickle cell disease? (2023) Centers for Disease Control and Prevention. Available at: https://www.cdc.gov/ncbddd/sicklecell/facts.html (Accessed: 03 February 2024).
[3] Adli, Mazhar (2018). The CRISPR tool kit for genome editing and beyond. Nature Communications, 9(1), 1911–. doi:10.1038/s41467-018-04252-2
Ana görsel: Image from the RCSB PDB (RCSB.org) of PDB ID 1BNA (H.R. Drew, R.M. Wing, T. Takano, C. Broka, S. Tanaka, K. Itakura, R.E.Dickerson, Structure of a B-DNA dodecamer: conformation and dynamics (1981) Proc.Natl.Acad.Sci.USA 78: 2179-2183).


